京都大学大学院医学研究科 実験動物学分野研究室
(附属動物実験施設)

【脳神経系や発生過程におけるエピジェネティック制御の役割】
多くの生物種のゲノムが解読されましたが,遺伝情報の発現にはDNAのメチル化やヒストン修飾が重要な役割を果たしています。このような制御をエピジェネティック制御と呼び,「DNAの塩基配列の変化を伴わず,細胞世代を超えて維持される遺伝子発現記憶のメカニズム」と定義されます。エピジェネティック制御の異常は,精神疾患や生活習慣病,がんなどの発症に深く関わっています。
私たちは,脳神経系や発生過程の複雑な系におけるエピジェネティック制御の役割を解明するために,遺伝子改変マウスを用いて研究を行なっています。特にヒストン修飾に注目して,ヒストンの特定のアミノ酸のメチル基を認識するヘテロクロマチンプロテイン1(HP1)や,特定のアミノ酸のメチル基を除去するJmjd3, Utxの遺伝子改変マウスを作製して,脳神経系や発生過程での解析を行い,ヒストン修飾の役割を解明しようとしています。
Naruse C, Abe K, Yoshihara T, Kato T, Nishiuchi T, Asano M. Heterochromatin protein 1γ deficiency decreases histone H3K27 methylation in mouse neurosphere neuronal genes. FASEB J. 34(3):3956-3968, 2020.
京大HP http://www.kyoto-u.ac.jp/ja/research/research_results/2019/200121_3.html
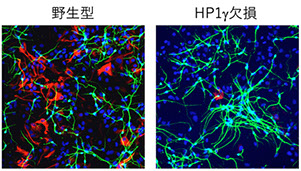
ヘテロクロマチンプロテイン(HP)1には、遺伝子が使用されないときにヘテロクロマチンと呼ばれる凝集構造を形成して、遺伝子が読み取られないようにする(転写抑制)機能があります。これまでHP1γは、転写抑制の目印である、ヒストンH3の9番目のリジン(H3K9)のメチル化と密接に関係していると考えられてきました。本研究グループは、HP1γが別の転写抑制の目印である、ヒストンH3の27番目のリジン(H3K27)のメチル化の維持にも関与していることを明らかにしました。
HP1γが欠損した神経幹細胞はアストロサイト(写真の赤色)よりもニューロン(緑)に分化する傾向がありました。本研究により、HP1γは、メチル化H3K27の脱メチル化酵素であるJMJD3およびUTXがニューロン特異的な遺伝子に近づくのを妨げることにより、メチル化H3K27を維持してニューロンへの分化を抑制していることが示唆されました。
本研究成果は、神経幹細胞をアストロサイトやニューロンに正常に分化させるための制御には、ヒストン修飾を正常に保つことが必須であることを示唆しており、脳や神経の再生医療などへの応用が考えられます。
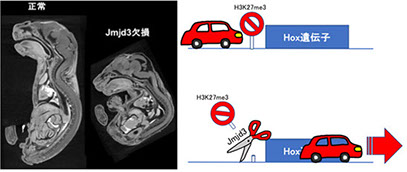
Naruse, C., Shibata, S., Tamura, M., Kawaguchi, T., Abe, K., Sugihara, K., Kato, T., Nishiuchi, T., Wakana, S., Ikawa, M., and Asano, M. “New insights on the role of Jmjd3 and Utx in axial skeletal formation in mice.” FASEB Journal, 2017
Jmjd3欠損マウスは脊椎後弯と肋骨の異形成を示しました(左図)。Hox遺伝子は発現を抑制する「印」であるH3K27me3が取り除かれないと発現しませんが(右図),Jmjd3欠損マウスでは,この「印」が適切に取り除かれないため,Hox遺伝子の発現が乱れて脊椎後弯や肋骨の異形成が生じたと考えられました。
Thai, To-Ha., Sun, M., Ha, N., Pham, D-H., Frederick, M., Sharma, B., Naruse, C., Asano, M., Pipkin, M. and George, R. “Cbx3/HP1γ deficiency confers enhanced tumor killing capacity on CD8+ T cells.” Scientific Reports, 2017 in press.
Wu, W., Nishikawa, H., Fukuda, T., Vittal, V., Asano, M., Miyoshi, Y., Klevit, R.E. and Ohta, T. “Interaction of BARD1 and HP1 is required for BRCA1 retention at sites of DNA damage.” Cancer Research 75; 1311-21, 2015
Ha, N., Pham, D-H., Naruse, C., Asano, M., and Thai, T-H. “HP-1γ controls high-affinity antibody response to T-dependent antigens.” Frontiers in Immunology 5: 271, 2014.
Ohno R, Nakayama M, Naruse C, Okashita N, Takano O, Tachibana M, Asano M, Saitou M, Seki Y. A replication-dependent passive mechanism modulates DNA demethylation in mouse primordial germ cells. Development140; 2892-903, 2013.
Abe K, Naruse C, Kato T, Nishiuchi T, Saitou M, Asano M. Loss of heterochromatin protein 1γ reduces the number of primordial germ cells via impaired cell-cycle progression. Biol Reprod 85; 1013-24, 2011.
HP1γを欠損した始原生殖細胞は,最初は正常なマウスと同じ数出現するものの,細胞周期の進行が遅いために増殖が遅く,最終的に成熟した生殖細胞数が極端に少なくなることを明らかにしました。
*Takada Y, *Naruse C, *Costa Y, Shirakawa T, Tachibana M, Sharif J, Kezuka-Shiotani F, Kakiuchi D, Masumoto H, Shinkai Y, Ohbo K, Peters AH, Turner JM, #Asano M, #Koseki H. HP1γ links histone methylation marks to meiotic synapsis in mice. Development 138; 4207-17, 2011. *equally contribution, #equally correspondence.
HP1γを欠損した生殖細胞ではヒストン修飾の一つであるH3K9me2が減少し,減数分裂の途中で染色体がうまく分かれず減数分裂の進行が途中で停止してしまい,成熟した生殖細胞がほとんど形成されないことを明らかにしました。